小麦赤霉病(FHB)是一种全球性的毁灭性真菌病害,不仅会导致小麦减产,还会产生脱氧雪腐镰刀菌烯醇(DON)等真菌毒素,危害人畜健康。培育和种植抗赤霉病小麦品种是控制该病害最有效的途径之一。Fhb1遗传位点是目前为止效应最大的赤霉病抗性QTL,被广泛应用于世界各麦区的抗病育种中。
2024年4月23日,我校新葡的京集团8814张正光教授领衔的“稻麦真菌病害与控制”团队李刚教授课题组联合江苏省农科院、澳大利亚阿德莱德大学等单位,在国际学术期刊Cell Host & Microbe在线发表了题为 “A phase-separated protein hub modulates resistance to Fusarium head blight in wheat” 的研究论文(封面文章)。该研究揭示了Fhb1位点关键基因编码蛋白TaHRC通过“液-液”相分离驱动大分子凝聚复合体调控小麦抗感赤霉病的作用机制。

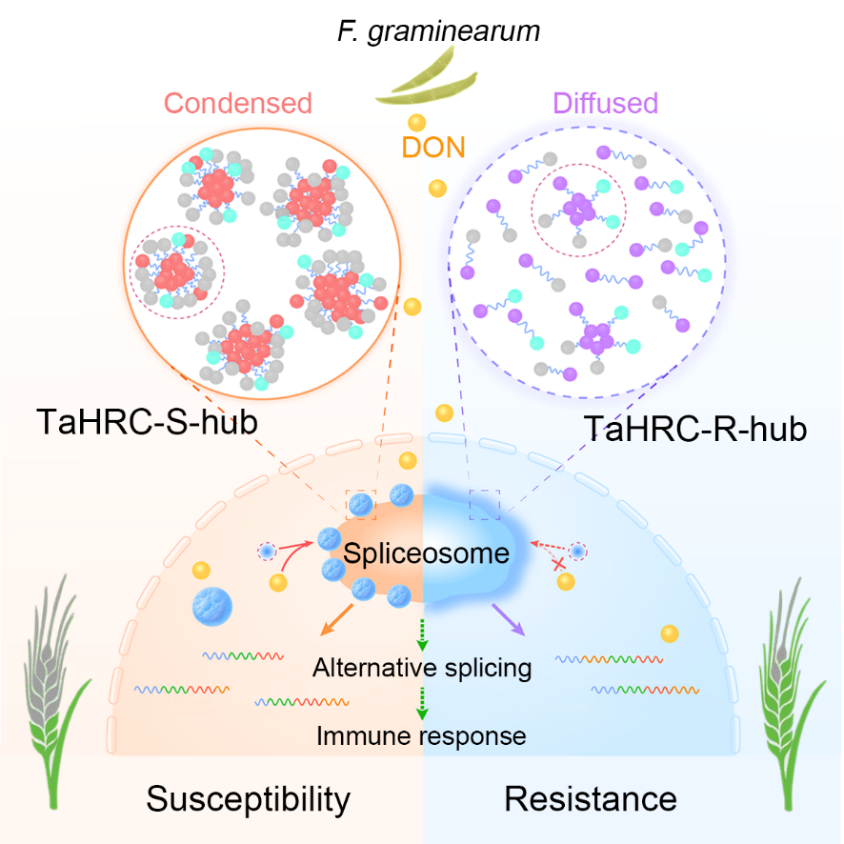
Fhb1的关键基因—TaHRC (编码组氨酸富集钙结合蛋白)在2019年被克隆,TaHRC感(S)和抗(R)等位基因的编码蛋白仅在N端的前21个氨基酸存在差异,但其确切的抗感机制仍不清楚。在此基础之上,该研究发现TaHRC-S和-R等位基因编码蛋白均能在细胞核中通过“液-液”相分离形成凝聚体,但其各凝聚态的分子间交换效率不同,TaHRC-S表现出更强的相分离潜力。同时发现,TaHRC-S响应毒力因子DON毒素形成凝聚体,并促进DON介导的细胞死亡,从而引发赤霉病扩展(感病),而TaHRC-R蛋白的凝聚体对DON不敏感,抑制DON介导的细胞死亡,最终表现为赤霉病抗性功能。
进一步研究发现,TaHRC-S和-R招募相同的可变剪切蛋白复合体,形成HRC-hub,该复合体包括剪切体组分蛋白U1和Ser/Arg-rich可变剪切因子TaSR45a等。TaHRC-S能驱动HRC-hub成员的相分离,形成高凝聚态的HRC-S-hub;而TaHRC-R则抑制hub成员的相分离,导致形成非凝聚态(弥散态)的TaHRC-R-hub;该结果阐明了TaHRC-S和-R通过相反的机制驱动其复合体成员的相分离,进而分别维持复合体的“凝聚态和非凝聚态”,从而发挥赤霉病“感与抗”的功能。
最后,通过人工遗传改造hub关键成员TaSR45a剪切因子的凝聚体状态,明确了不同凝聚态的TaHRC-TaSR45a通过调节pre-mRNA可变剪接的稳定性和免疫应答,最终介导小麦对赤霉病的抗病性和感病性。
综上所述,该研究系统揭示了Fhb1关键基因编码蛋白通过驱动凝聚复合体调控小麦对赤霉病抗/感病性的生物学机制,为作物应答病害通路的探究和抗性育种利用提供了全新的思路。
新葡的京集团8814为第一署名单位,新葡的京集团8814稻麦真菌病害与控制团队李刚教授为论文通讯作者,江苏省农科院小麦遗传育种团队何漪副研究员、澳大利亚阿德莱德怀特研究所Xiujuan Yang博士和新葡的京集团8814植保学院在读博士生夏小波为论文共同第一作者。稻麦真菌病害与控制团队负责人张正光教授参与了该研究的指导工作。该研究得到国家重点研发计划、国家自然科学基金等项目的支持。
论文链接:https://doi.org/10.1016/j.chom.2024.04.002
编:李刚
校:唐莉栋
审:许承保